I OBIECUJĘ CI, ŻE… CZYLI DLACZEGO WARTO DOKŁADNIE CZYTAĆ DEKLARACJE KOSMETYCZNE
Na jakie deklaracje kosmetyczne warto zwrócić uwagę
12/21/202412 min read
Czasem mam wrażenie, że świat kosmetyków działa na zasadzie nikt ci nie da tyle, ile ja ci mogę obiecać. I samo w sobie nie jest to takie złe, ale… Pewne deklaracje nie powinny się pojawiać, inne należy potępić. Chciałabym zwrócić Waszą uwagę na kilka deklaracji, gdyż na podobne natkniecie się pewnie nie jeden raz.
Czym są deklaracje na temat kosmetyku?
Choć wydawać się może, że deklaracje to czysty marketing i samowolka, w przypadku kosmetyków obowiązuje Rozporządzenie 655/2013, które mówi, że oświadczenie:
· może mieć formę tekstów, nazw, znaków towarowych, obrazów, symboli i innych znaków,
· informuje bezpośrednio lub pośrednio o właściwościach lub funkcjach produktu,
· dotyczy etykietowania, udostępniania na rynku i reklamowania produktów kosmetycznych,
· ma być przydatne, zrozumiałe i wiarygodne,
· ma umożliwiać podejmowanie świadomych decyzji oraz wybieranie produktów, które najlepiej odpowiadają potrzebom i oczekiwaniom konsumenta.
Zasady, które wprowadza ten akt prawny dotyczą „wszystkich oświadczeń, niezależnie od nośnika i rodzaju zastosowanego narzędzia marketingowego, objętego oświadczeniem działania produktu i docelowych odbiorców.” Głównym celem ustanowionych wspólnych kryteriów jest zapewnienie wysokiego poziomu ochrony użytkowników końcowych (konsumentów i profesjonalistów), w szczególności przed wprowadzającymi w błąd oświadczeniami dotyczącymi kosmetyków.
Za oświadczenia o produkcie odpowiada osoba odpowiedzialna, a więc podmiot, który jest wskazany na etykiecie kosmetyku.
WSPÓLNE KRYTERIA DOTYCZĄCE OŚWIADCZEŃ
1. Zgodność z przepisami – czyli nie deklaruje się zgodności z minimalnymi wymaganiami prawnymi, np. że produkt jest wytwarzany zgodnie z zasadami GMP, bo to jest obowiązek;
2. Prawdziwość udzielanych informacji – czyli jeśli deklaruje się obecność jakiegoś składnika, to musi on być obecny, a opieranie się na jego właściwościach jest dopuszczone, jeśli cały produkt również takie cechy wykazuje, np. produkt zawiera nawilżający miód, nie jest dozwolone, jeśli w kosmetyku jest tylko aromat miodowy, a właściwości nawilżające produktu nie są potwierdzone;
3. Dowody – czyli oświadczenia muszą być poparte odpowiednimi, sprawdzalnymi dowodami, których zakres i jakość musi być zgodna z oświadczeniem, np. deklaracja, że krem wygładza zmarszczki o 30% musi mieć poparcie w badaniach, które w sposób mierzalny potwierdzają takie wartości, a sposób przeprowadzania takich badań jest zgodny z zasadami metrologii czy statystyki;
4. Zgodność ze stanem faktycznym – opis działania produktu nie wykracza poza to, na co mamy dowody, a jeśli dla określonego efektu konieczne są specyficzne warunki, musi to być jasne, np. nie deklaruje się na szamponie, że włosy są odczuwalnie miększe w dotyku, jeśli dla takiego efektu należy zastosować i szampon i odżywkę;
5. Uczciwość – oświadczenia muszą być obiektywne, nie mogą oczerniać konkurencji, ani legalnie stosowanych składników, np. deklaracja „bez szkodliwego fenoksyetanolu” nie jest poprawna, gdyż składnik ten można stosować w kosmetykach
6. Świadome podejmowanie decyzji – oświadczenia są jasne, zrozumiałe (dla przeciętnej osoby) i pozwalają na podjęcie świadomego wyboru, czyli używanie niezrozumiałego języka fachowego, nie powinno mieć miejsca
Przejdźmy więc do deklaracji.
Jedzenie kosmetyków
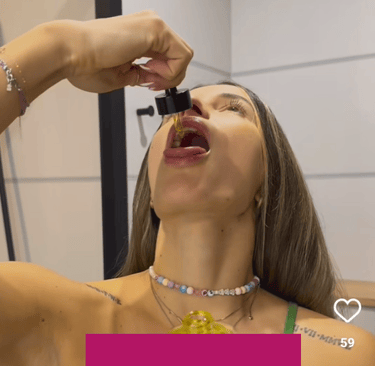
Jak mówi już sama definicja kosmetyku, jest to produkt przeznaczony do stosowania na zewnętrzne części ciała (oraz błonami śluzowymi jamy ustnej). Kosmetyku się nie je. Oczywiście możliwe jest, że część produktu zostaje zjedzona w wyniku normalnego używania, np. pomadki do ust czy produkty do higieny jamy ustnej. Taką ewentualność bierze się pod uwagę przy ocenie bezpieczeństwa, jeśli rodzaj produktu, sposób jego użycia dają możliwość narażenia drogą pokarmową. Nawet jeśli cały kosmetyk jest oparty na surowcach jakości spożywczej (co nie jest zabronione), nie sprawi to, że będzie nadawał się do jedzenia. Pełna „naturalność” składników również nie spowoduje, że kosmetyk można zjeść.
O ile przyzwyczailiśmy się (niestety) do mydełek w kształcie ciasteczek czy kul do kąpieli, które wyglądają jak babeczki, to pokazywanie:
- nalewania serum do kieliszka, jak do toastu,
- nabierania peelingu na łyżeczkę i prawie wkładanie jej do ust,
- „produktu tak naturalnego, że wręcz jadalnego”,
- wkraplania serum do ust, a następnie masażu twarzy tym samym produktem,
- zdjęć okolic ust ubrudzonych czymś w tym samym kolorze, co reklamowana maseczka, jakby ktoś właśnie oblizywał się po pysznym deserze,
jest bardzo złą praktyką.
Oburzamy się na produkty przeznaczone dla dzieci, które przypominają żywność, ale nie mamy problemu z tym, że sugeruje się nam, że można zjeść krem, serum czy peeling. Opakowania tych produktów wcale nie przypominają żywności, ale taki sposób przekazu, jak opisałam powyżej, jest według mnie przekroczeniem także zakresu metafory. Nie jest fair wmawianie konsumentom, że produkt jest tak naturalny, czysty czy bezpieczny, że można go zjeść. Nie jest to prawdziwe, zgodne ze stanem faktycznym, ani uczciwe.
O "jedzeniu" kosmetyków pisałam również tutaj.


Filtr HEV
Deklaracje odnoszące się do ochrony przeciwko promieniowaniu UV są bardziej regulowane – mamy normy ISO pozwalające wyznaczać SPF lub poziom ochrony przeciwko UVA, do tego wytyczne Komisji odnośnie oznakowania takich kosmetyków. Takiego zaplecza merytorycznego i legislacyjnego nie ma ochrona przed promieniowaniem niebieskim, czyli HEV (High Energy Visible Light). A coraz częściej spotykamy się z produktami, które deklarują ochronę przed tym rodzajem promieniowania. Należy jednak rozróżnić dwa typy deklaracji – filtry HEV oraz ochronę przed negatywnymi skutkami tego rodzaju promieniowania.
Przypomnę definicję „substancji promieniochronnej” (czyli w mowie potocznej filtra UV) z Rozporządzenia 1223/2009. Jest to substancja przeznaczone wyłącznie lub głównie do ochrony skóry przed niektórymi rodzajami promieniowania ultrafioletowego przez pochłanianie, odbijanie lub rozpraszanie tego promieniowania. Mamy więc jasne wskazanie mechanizmu działania – to blokowanie możliwości przedostania się promieniowania do głębszych warstw skóry.
Kiedy więc konsument spotyka taką deklarację:


może spodziewać się, że w produkcie jest obecny składnik, który działa jak filtr HEV – minimalizuje penetrację promieniowania z tego zakresu. Okazało się, że tym filtrem HEV ma być karnozyna.















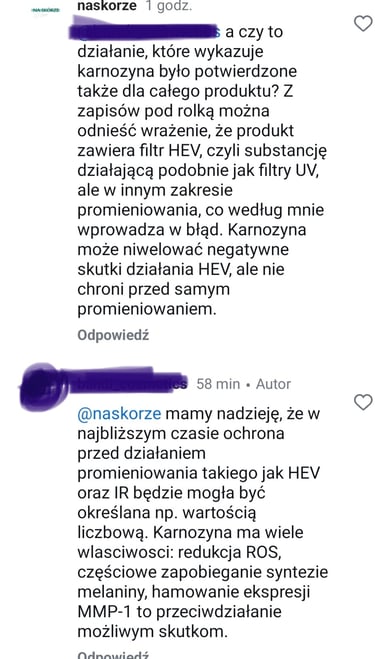
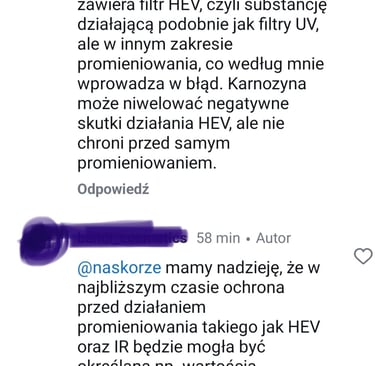
Niestety – karnozyna nie może być filtrem HEV, gdyż nie wykazuje absorpcji w tym zakresie długości fal (ok. 400 – 500 nm), co widać na tym wykresie (przy tym zakresie długości fali powinien być widoczny wyraźny pik – wówczas substancja „pochłania” takie promieniowanie)
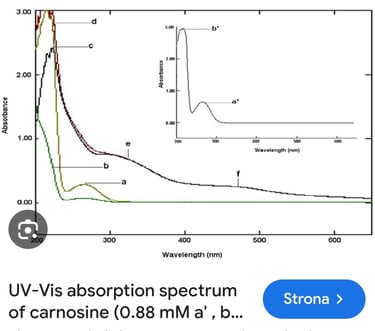
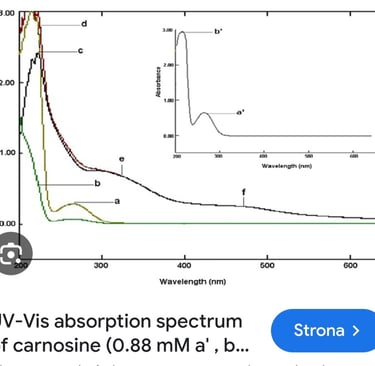
Karozyna literaturowo wykazuje działanie, o którym wspomina producent. Jednak nie jest to ochrona przed samym promieniowaniem, a przed jego negatywnymi skutkami. Nie jest to to samo. Oprócz tego, że składnik działa we wskazanym sposób, takie same właściwości powinien wykazywać cały produkt. Niestety producent wykazuje się również niewiedzą – otóż istnieją metody do ilościowego wyznaczania absorpcji promieniowania HEV, nie są one zharmonizowane (tak jak dla filtrów UV), ale laboratoria i ośrodki badawcze potrafią przeprowadzić takie analizy.


Sami oceńcie, czy zapewnianie, że produkt zawiera filtr HEV (mimo że to nieprawda) to „przyjazne użytkownikom oznakowanie”, czy jednak brak dowodów, uczciwości i zgodności ze stanem faktycznym.
Również sama obecność składnika wykazującego daną aktywność nie jest jednoznaczna z tym, że cały produkt taką właściwość będzie posiadać. W Dokumencie Technicznym dotyczącym oświadczeń dla kosmetyków dla kryterium „prawdziwości udzielanych informacji” podano przykład – deklaracja zawiera nawilżający aloes nie powinna być stosowana, jeśli cały produkt nie wykazuje właściwości nawilżających. Analogicznie – nie można deklarować ochrony przed HEV tylko na podstawie obecności substancji mogącej absorbować promieniowanie z tego zakresu lub składnika, który teoretycznie wykazuje działanie ochronne przed negatywnymi skutkami HEV, jeśli takiego działania nie potwierdzono dla całej formulacji (brak takich informacji nie musi oznaczać, że marka takich badań nie wykonała, ale dla mnie jest czerwoną flagą).


Niestety w wielu przypadkach deklaracji ochrony przed promieniowaniem HEV przeciętny konsument nie jest w stanie ocenić, skąd bierze się taka deklaracja i czy jest poprawna. Z moich obserwacji wynika jednak, że marki, które przeprowadziły odpowiednie badania na działanie ochronne przed promieniowaniem HEV lub IR wprost się tym chwalą i informują, jakie badania zostały przeprowadzone. Lub wyraźnie rozróżniają dwa typy działania (filtru i przeciwdziałaniu negatywnym skutkom). I brawo za to!




Kosmetyk „biobójczy”
Kosmetyk nie może wykazywać działania biobójczego, antybakteryjnego, przeciwdrobnoustrojowego, przeciwgrzybiczego, antyseptycznego, dezynfekującego, jako swojej głównej funkcji. W takim przypadku produkt podlega pod inną niż kosmetyczna legislację – dotyczącą produktów biobójczych. Jasno mówi o tym między innymi dokument Borderline Manual.
Jak więc podejść do poniższej deklaracji?


Mimo to, w mediach produkt jest przedstawiany jako „innowacyjny kosmetyk”, a nie produkt biobójczy (produkt nie widnieje również w wykazie produktów biobójczych). Jest to nieuczciwe i uniemożliwia świadome podejmowanie decyzji konsumentom.
Składniki kosmetyczne na choroby skóry i kosmetyki, które leczą
Podobnie jak kosmetyki nie mogą działać biobójczo, nie mogą również leczyć. Kosmetyki można stosować do pielęgnacji skóry w jednostkach chorobowych, ale nie można deklarować, że będą one leczyć.


Co więcej, na stronie producenta znajdziemy również wyniki badań skuteczności biobójczej i wirusobójczej.


Nie można deklarować działania leczniczego dla kosmetyku. Niestety takie sformułowania przewijają się wśród deklaracji wielokrotnie. Na szczególne potępienie zasługują ci, którzy używają ich w reklamowaniu kosmetyków dla niemowląt i dzieci. Przyszli rodzice i osoby, które dopiero co doświadczyły narodzin dziecka, są szczególnie wrażliwą grupą konsumencką – chcą dla swojego dziecka jak najlepiej, a zalewani są ogromem informacji, z których wiele jest kłamstwem. To naprawdę trudne zadanie, by nie ulec wszystkim namowom konieczności posiadania danych kosmetyków, w tym tych, które są przecież naturalne, przeznaczone do skóry wrażliwej i jeszcze leczą! W tym roku były już wycofania z rynku produktów przez Główny Inspektorat Farmaceutyczny właśnie z powodu błędnej klasyfikacji – produkty wprowadzono na rynek jako kosmetyki, tymczasem ich skład, prezentacja i wskazania sugerowały działanie lecznicze (linki do decyzji GIFu w źródłach pod tekstem).
Wiele osób nie zdaje sobie również sprawy z tego, że wiele wyrobów medycznych na pierwszy rzut oka przypomina kosmetyk – mają podobny design, oznakowanie. Tak jak leki i produkty biobójcze, wyroby medyczne podlegają także osobnym regulacjom. Jak odróżnić kosmetyk od wyrobu medycznego? W skrócie – wyrób medyczny musi mieć oznakowanie CE, które poświadcza, że jest zgodne z europejskimi normami oraz jasny zapis „wyrób medyczny” lub MD:




Stabilność kosmetyku a jego jakość
Jednym z obowiązkowych elementów oznakowania kosmetyku jest podanie terminu ważności w postaci daty minimalnej trwałości (jeśli wynosi ona poniżej 30 miesięcy) lub PAO (jeśli trwałość jest dłuższa niż 30 miesięcy). Data, do której dany produkt kosmetyczny, przechowywany w odpowiednich warunkach, zachowuje w pełni swoje pierwotne właściwości i jest bezpieczny dla ludzi, musi więc być w odpowiedni sposób określona – w tym celu przeprowadza się badania stabilności masy i jej kompatybilności z opakowaniem. W ich trakcie obserwuje się podstawowe parametry fizykochemiczne, m.in. wygląd, zapach, barwę, konsystencję, lepkość, pH, ale i określa czy następuje rozwarstwienie emulsji, rozdzielenie faz, wytrącenie osadu itd. Odstępstwa od założonej specyfikacji masy mogą być wynikiem błędów przy projektowaniu receptury (np. źle dobrany emulgator lub jego ilość, brak kompatybilności składników), a w związku z tym mogą przekładać się później na jakość rozumianą w aspekcie wizualnym, ale przede wszystkim bezpieczeństwa (działania układu konserwującego) czy efektywności.
Gdy widzę taki zapis:


Wcale nie jestem przekonana, że rozwarstwienie kremu nie będzie wpływało na jego jakość. Dla każdego technologa rozwarstwienie emulsji to moment, w którym należy ponownie pochylić się nad recepturą.
Zawsze należy chwalić, gdy producent wykonuje badania zawartości składników aktywnych w czasie badań stabilności. Wiele z takich substancji wykazuje mniejszą lub większą podatność do rozkładu, a więc z czasem – mniejszej efektywności. Stąd też w formułach pojawiają się przeciwutleniacze czy chelatory – aby minimalizować degradację składników aktywnych. Pamiętajmy również, że stężenia, które podają producenci dotyczą sytuacji startowej, czyli ilości, które są dodawane na etapie produkcji. Poniższa deklaracja jest bardzo ciekawa:




Producent oświadcza, że stężenie składników aktywnych nie zmienia się przez cały okres PAO, który wynosi 6 miesięcy. Jak mam jednak ją poprawnie interpretować? Czy testy na zawartość retinolu były wykonane po 36 miesiącach (przechowywanie zamkniętego opakowania 30 miesięcy, bo taka powinna być minimalna trwałość przy PAO, później otwarcie produktu i po 6 miesiącach badanie)? Raczej wątpię, bo w kosmetykach prowadzi się najczęściej tzw. przyspieszone testy stabilności (w podwyższonej temperaturze, co pozwala skrócić czas badań, standardowo przyjmuje się, że „próbka przechowywana w 45°C przez 8‑12 tygodni, nie wykazująca znaczących zmian względem specyfikacji produktu, jest wyznacznikiem stabilności przez 2 lata w warunkach temperatury pokojowej”). Dla mnie tak sformułowana deklaracja jest ciężka do zrozumienia…
Hipoalergiczność
Deklaracje odnośnie hipoalergiczności kosmetyku zostały specjalnie omówione w Dokumencie technicznym dotyczącym oświadczeń (link w źródłach). Osoba odpowiedzialna musi posiadać dostateczne dowody na potwierdzenie, że produkt został zaprojektowany w taki sposób, by minimalizować ryzyko wystąpienia alergii. W tym celu kosmetyki hipoalergiczne nie mogą zawierać znanych alergenów lub ich prekurosorów, w szczególności:
- substancji uczulających ocenionych przez SCCS lub wskazanych przez inne oficjalne jednostki związane z oceną ryzyka,
- są klasyfikowane w kategorii 1 lub 1A lub 1B według kryteriów CLP,
- zostały zidentyfikowane przez firmy na podstawie monitoringu rynku,
- są ogólnie znane z takiego działania na podstawie literatury naukowej,
- brakuje istotnych informacji na temat ich działania uczulającego.
Często wykonuje się także dodatkowe badania dermatologiczne i aplikacyjne z udziałem osób o skórze wrażliwej.
Czy taka deklaracja jest więc zgodna z wymogami odnośnie hipoelargiczności?


Lanolina ma literaturowo wykazany potencjał alergizujący, alkohol lanolinowy jest również obecny w Polskiej Serii Podstawowej do testów płatkowych, czyli zestawie 30 substancji najczęściej uczulających w Polsce. Mimo że obecnie znane są sposoby dobrego oczyszczania lanoliny, jej obecność w produkcie deklarującym hipoalergiczność może słusznie budzić kontrowersje.
Więcej o lanolinie przeczytacie we wpisie o Alergenie Roku 2023.
Ach te deklaracje…
Tworzenie deklaracji to trudny etap w tworzeniu produktu – trzeba pogodzić wizje marketingową, R&D i sprzedażową. Niestety nierzadko zdarza się, że oświadczenia są na wyrost, niepoparte odpowiednimi dowodami lub ich potwierdzenie opiera się na niepoprawnych przesłankach. Coraz częściej marki upubliczniają wyniki badań aplikacyjnych lub aparaturowych – są to na pewno ważne dla konsumentów dane. W tym ogromie różnych informacji łatwo się pogubić, dać nabrać lub nawet oszukać. Bądźmy uważni.
Źródła:
Stabilność kosmetyku, czyli jak upewnić się, że produkt pozostanie jak nowy
Dokument techniczny o oświadczeniach na produktach kosmetycznych
Zdjęcia pochodzą ze stron internetowych i materiałów udostępnianych w social mediach.


