Pierwszy na świecie zatwierdzony test toksykologiczny bez zwierząt
Metody KeratinoSens oraz h-CLAT w ocenie potencjału uczulającego na skórę.
Pierwszy na świecie zatwierdzony test toksykologiczny bez zwierząt
Często można spotkać się z twierdzeniem, że międzynarodowe koncerny nie dbają o dobrostan zwierząt i nie liczą się z ruchem cruelty-free. Tymczasem dzięki tym ogromnym przedsiębiorstwom możliwy jest postęp w tworzeniu tzw. alternatywnych metod badawczych. Niedawno BASF (największe przedsiębiorstwo chemiczne na świecie) i Givaudan (największy na świecie producent substancji zapachowych) ogłosiły, że opracowana przez nich strategia badawcza, mająca służyć przewidywaniu alergizującego na skórę działania substancji, została zatwierdzona przez OECD. OECD, czyli Organizacja Współpracy Godpodarczej i Rozwoju, zatwierdza metody, dając gwarancję, że dają one realistyczne wyniki, są zwalidowane i nadają się do powszechnego wykorzystania. Prace nad tym zagadnieniem trwały ponad 10 lat, ale dzięki temu możliwe jest zupełne zrezygnowanie z wykorzystania zwierząt do tego rodzaju badań toksykologicznych, co do tej pory było niezbędne.
Kiedy ocenia się działanie uczulające na skórę?
W Unii Europejskiej dane dotyczące właściwości uczulających na skórę danej substancji powinny zostać przedstawione dla substancji, które podlegają rozporządzeniu REACH (m.in. produkcja powyżej tony rocznie) oraz do celów klasyfikacji i oznaczania zgodnie z CLP. Mimo istnienia metod alternatywnych, wynik żadnej z nich nie mógł samodzielnie stanowić o klasyfikacji jako substancja uczulająca na skórę. Metoda spełniająca wymogi regulacyjne musi:
- rozróżniać substancje uczulające od nieuczulających,
- określać potencjał uczulający,
- zapewnić pomiar ilościowy.
Dodatkowo test in vitro nie znajdują zastosowania dla substancji lipofilowych i silnie cytotoksycznych i mogą być dwuznaczne. Stąd najczęściej ocena dla nowych substancji kończyła się testami na zwierzętach - Guinea Pig Maximization Test (świnkom morskim aplikowano substancję poprzez wstrzyknięcie śródskórne i/lub aplikację miejscową z okluzją) i Local Lymph Node Assay (substancję aplikuje się do węzłów chłonnych ucha myszy i mierzy indukowaną w ten sposób proliferację limfocytów). Do tej pory nawet dane używane z kombinowanego użycia metod in chemico, in vitro czy QSAR (in silico - modelowanie komputerowe) nie były oficjalnie uważane za zamienniki danych uzyskanych z badań na zwierzętach. Klasyfikacja substancji uczulających na skórę zgodnie z GHS/CLP wyróżnia:
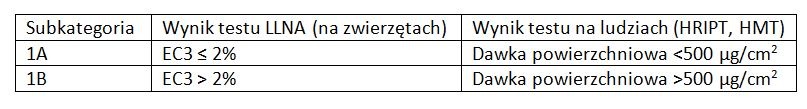
EC3 - ilość substancji wymagana do wywołania 3-krotnego wzrostu proliferacji w teście LLNA w porównaniu do kontroli
Zalecenia SCCS do oceny bezpieczeństwa kosmetyków mówią o podziale substancji uczulających na skórę na trzy kategorie, według wartości EC3:
- skrajnie uczulające, gdy EC3 ≤ 0,2%,
- silnie uczulające, gdy EC3 >0,2% - ≤ 2%,
- umiarkowanie uczulające, gdy EC3 >2%.
Ocena toksykologiczna składników produktu kosmetycznego, która obejmuje także działanie uczulające na skórę, jest częścią raportu bezpieczeństwa. Są to niezwykle ważne informacje, szczególnie w kontekście stosowania produktów na skórę.
Czy w UE można testować kosmetyki na zwierzętach?
Z prawnego punktu widzenia w UE obowiązuje zakaz testów na zwierzętach zarówno gotowych produktów jak i składników kosmetycznych. Przy ocenie toksykologicznej możliwe jest wykorzystywanie danych z badań na zwierzętach, które zostały uzyskane przed wprowadzeniem zakazu, nie można jednak prowadzić nowych testów z udziałem zwierząt. Wyjątkiem jest sytuacja, kiedy substancja jest używana również w innych gałęziach przemysłu i istnieją stosowne rozporządzenia (np. farmaceutycznym, spożywczym) lub kiedy takich danych wymagają inne regulacje (REACH - w kwestii oceny narażenia pracowników). Jeśli substancja ma wykorzystanie tylko w kosmetykach, metody in silico oraz in vitro będą wystarczające do oceny bezpieczeństwa. Jednak z toksykologicznego punktu widzenia zapewnienie, że dana substancja nie niesie ryzyka tylko na podstawie tych metod, jest ogromnym wyzwaniem.
Jaka jest alternatywa dla testów na zwierzętach?
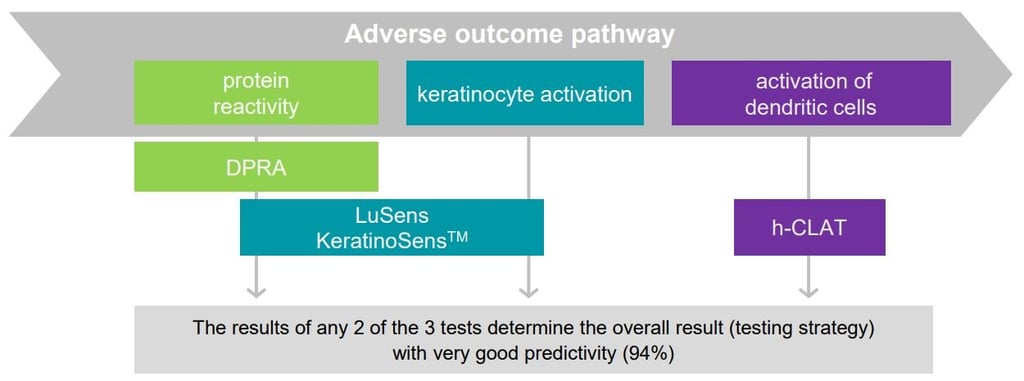
Strategia badawcza opracowana przez BASF i Givaudan składa się z trzech metod alternatywnych, do określania czy substancja może wywołać skórną reakcję alergiczną oraz dodatkowo nowej metody - Kinetic Direct Peptide Reactivity Assay (OECD 442C) - która pozwala przewidzieć, jak intensywna ta reakcja może być. Została ona umieszczona w opublikowanym w czerwcu 2021 przez OECD pod numerem 497 (Guideline No. 497: Defined Approaches on Skin Sensitisation; zawarty jest tam również opis dwóch innych metod, ale mają one znacznie gorszą swoistość) i jest tzw. podejściem 2 z 3, należące do grupy zintegrowanych strategii testowych (ang. ITS). Nie jest to nowy pomysł (w sensie nie został wymyślony w ostatnim czasie), ale wymagał sprawdzenia i walidacji, w tym międzylaboratoryjnej (m.in. określenie powtarzalności, precyzji, odtwarzalności itd.). Ten trudny proces zajął wielu współpracującym ośrodkom badawczym wiele lat. Obecnie udało się zwalidować strategię 2 z 3 tylko dla czystych substancji chemicznych, ale nie dla mieszanin i gotowych formulacji. Strategia ta opiera się na wnioskowaniu na podstawie pozytywnych wyników 2 z 3 przeprowadzonych badań, zgodnie ze schematem. Każde z badań odnosi się do innego "wydarzenia kluczowego" z modelu AOP i są to: DPRA, tzw. KeratinoSens oraz h-CLAT.
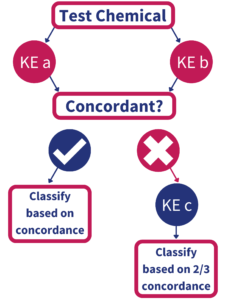
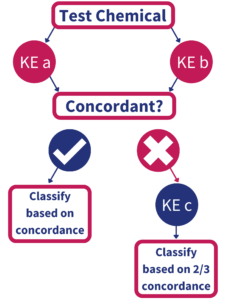
źródło : link
Jeśli wynik co najmniej dwóch z trzech testów jest pozytywny, substancję klasyfikuje się jako uczulającą na skórę; jeśli co najmniej dwa z trzech testów dają wynik negatywny - jako substancję nieuczulającą.
Czym jest AOP?
Wywoływanie przez substancje reakcji alergicznej jest skomplikowanym procesem, dlatego nie wystarczy jeden test, a konieczna jest interpretacja wyników z trzech badań. Do opracowywania metod badawczych stosuje się model AOP (adverse outcome pathway), który jest uproszczonym schematem pokazującym połączenie pomiędzy oddziaływaniem na poziomie cząsteczek, a oddziaływaniem na poziomie tkanek lub całych organizmów. Dla wywoływania skórnej reakcji alergicznej przez substancje wiążące się z białkami, model AOP wygląda następująco (ściślej rzecz ujmując jest to AOP dla pierwszej fazy - indukcji - procesu immunologicznego, jakim jest powstanie alergii skórnej):
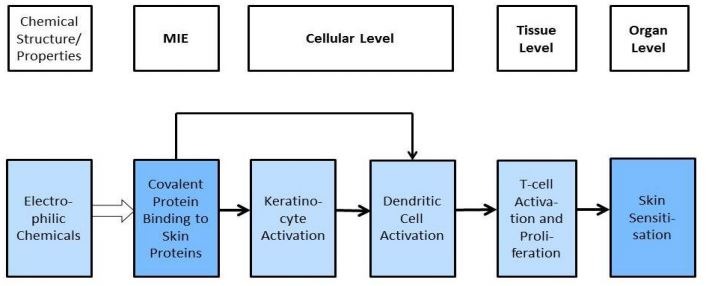
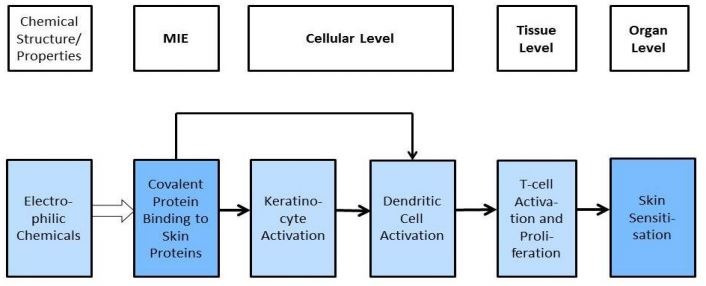
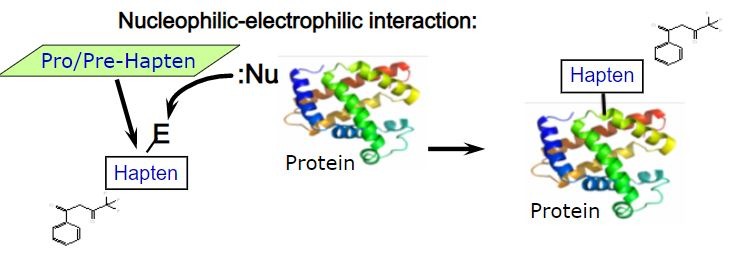
Cząsteczka zdolna do wiązania się z białkami musi posiadać odpowiednie właściwości elektrofilowe (może takie wykazywać sama z siebie lub może być do takiej postaci przekształcona enzymatycznie lub w reakcjach utleniania). Wówczas ma zdolność do wiązania się pewnymi miejscami białek, np. resztami cysteiny lub lizyny.
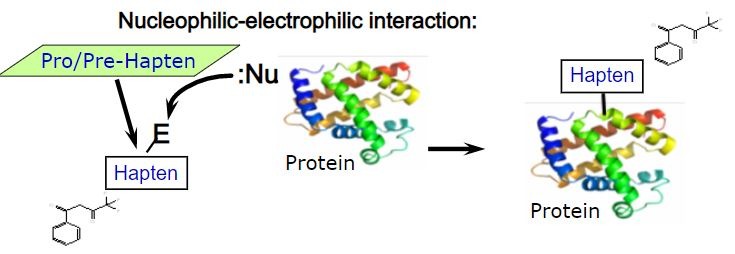
Następuje wówczas aktywacja keratynocytów i komórek dendrycznych, co prowadzi do aktywacji i proliferacji limfocytów T (komórek pamięci odpornościowej).
Metody wchodzące w strategię 2z3
Pierwsza z metod strategii to tzw. DPRA (Direct Peptide Reactivity Assay) OECD 442C, która opisuje pierwszy etap AOP - wiązanie się haptenów z białkami. Metoda została stworzona przez Procter&Gamble i jest tzw. metodą in chemico, tzn. opiera się na reakcji chemicznej, a nie wykorzystuje hodowli komórkowych. Określa się tutaj wiązanie cząsteczek badanej substancji do syntetycznych peptydów zawierających lizynę lub cysteinę po 24-godzinnej inkubacji, poprzez pomiar szybkości zubożenia (wyczerpywania się) peptydów za pomocą HPLC. Im większy % zubożenia, tzn. więcej cząsteczek substancji związało się z białkiem, tym silniej reaktywna jest badana substancja.
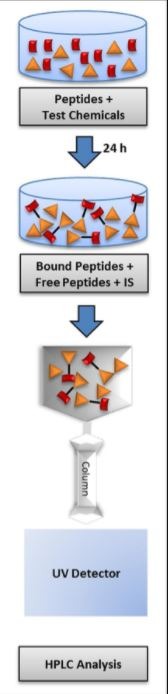
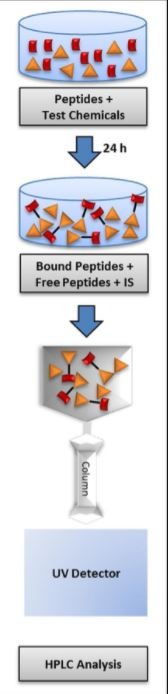
źródło link
Na podstawie wyników substancję można zakwalifikować do odpowiednich klas reakcyjności: minimalnej, niskiej, umiarkowanej i wysokiej.
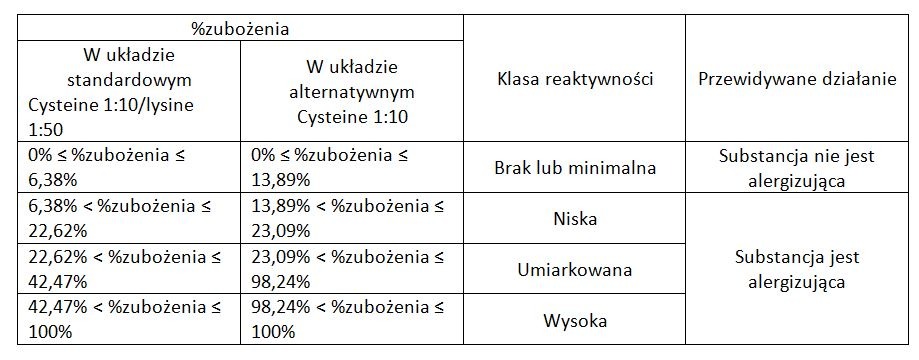
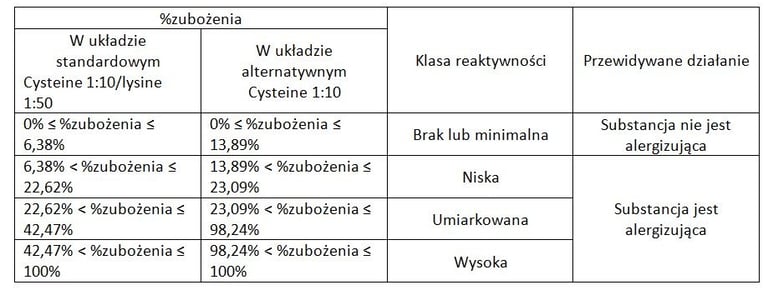
Przykładowo, dla formaldehydu zakres zubożenia cysteiny to 30-60%, co oznacza silny alergen, a dla kwasu mlekowego wynosi poniżej 7% (substancja nieuczulająca).
Druga z metod to ARE-Nrf2 Luciferase Assay OECD 442D, która dotyczy drugiego etapu AOP, związanego ze zmianą ekspresji genów w keratynocytach. Aktywowany jest wówczas specyficzny szlak sygnałowy ARE (antioxidant/electrophile response element). Jest to metoda in vitro, czyli z wykorzystaniem laboratoryjnych linii komórkowych, opracowana przez Givaudan. Zmodyfikowana linia keratynocytów zawiera gen lucyferazy (która ma zdolność do luminescencji), który znajduje się pod kontrolą tego samego promotora, co ARE. Podczas ekspozycji na substancję alergizującą, aktywowane są geny Nrf2, a poziom ekspresji można zmierzyć poprzez pomiar luminescencji, związanej z aktywowaną tym samym sposobem lucyferazą.
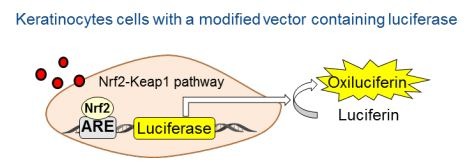
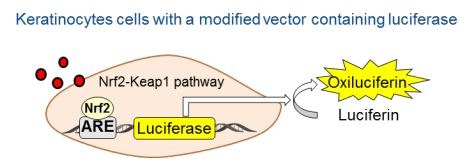
Najpowszechniej stosuję się metodę KeratinoSens™.
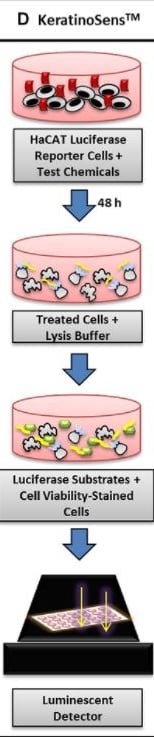
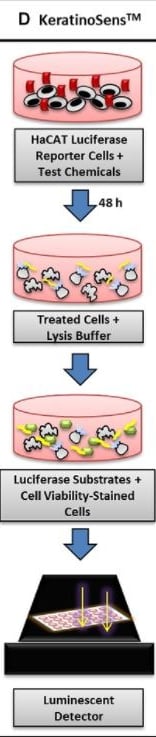
źródło link
Substancja jest kwalifikowana jako uczulającą, gdy:
- wywoła statystycznie istotną indukcję genu lucyferazy powyżej danego progu (1,5 raza większą lub równą tej wartości),
- żywotność komórek jest większa niż 70% dla najniższego stężenia indukującego aktywność lucyferazy powyżej progu,
- stężenie substancji, indukujące aktywność lucyferazy powyżej progu, jest mniejsze niż 1000 µM (lub <200 µg/mL, jeśli nie jest znana masa cząsteczkowa substancji),
- występuje zależny od dawki wzrost indukcji aktywności lucyferazy w dwóch lub co najmniej dwóch z trzech eksperymentów.
Poniżej przykładowe wyniki dla glicerolu (który nie jest alergenem) i aldehydu cynamonowego (alergen).
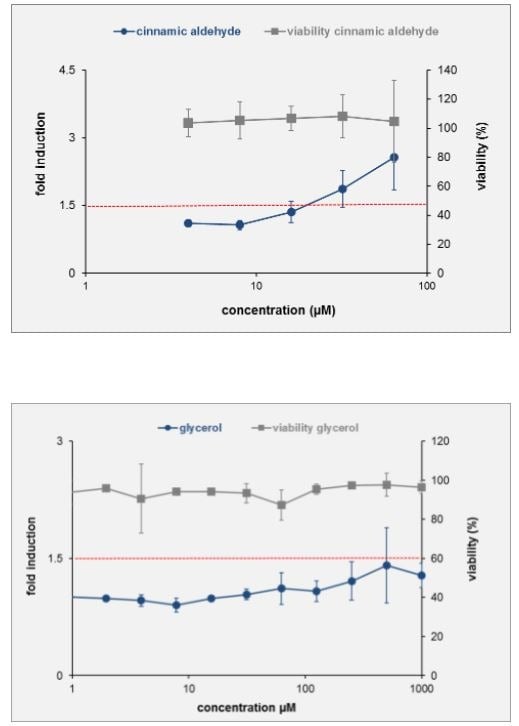
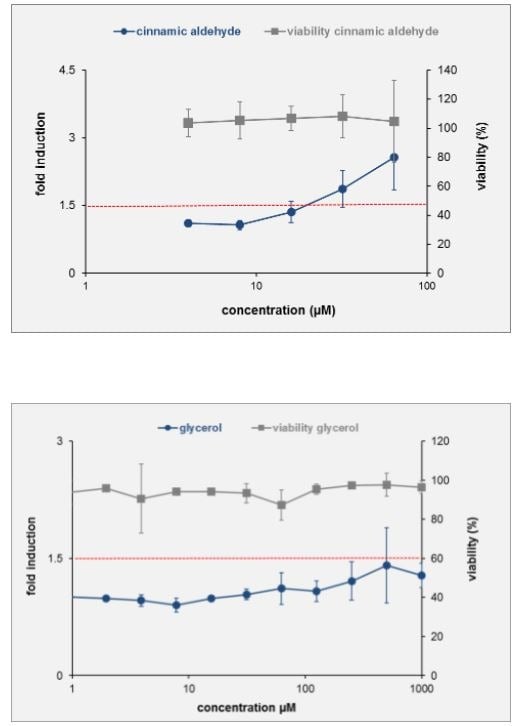
Trzecią metodą jest h-CLAT OECD 442E Human Cell Line Activation Test, odnoszący się do trzeciego etapu AOP - określa zmiany w ekspresji markerów na powierzchni komórek, związanych z aktywacją monocytów i komórek dendrycznych. Jest to metoda in vitro, która została opracowana przez Shiseido. Mierzona jest ekspresja markerów CD86 i CD54 błony komórkowej komórek THP-1 (human monocytic leukemia cell), jako modelu komórek dendrycznych.
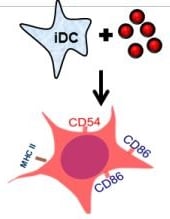
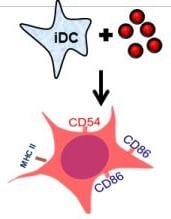
Poziom ekspresji mierzy się za pomocą cytometrii przepływowej, po 24-godzinnej inkubacji z substancją w kilku różnych stężeniach. Komórki są przedtem znakowane fluorochromowymi przeciwciałami (zliczane są tylko wyznakowane komórki, tj. te, do których dołączyły się specyficzne przeciwciała).
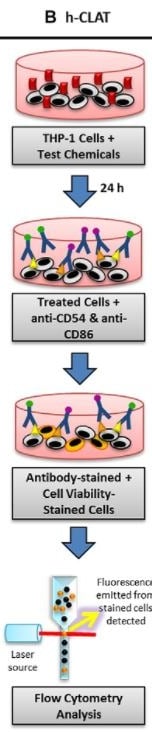
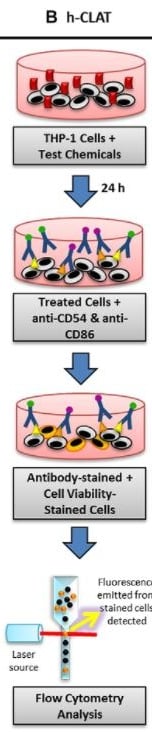
Na podstawie wyników eksperymentu, substancję klasyfikuje się jako uczulającą, gdy relatywna intensywność fluorescencji dla obu markerów przekracza poziom: CD86>150% i CD54>200%, a żywotność komórek wynosi co najmniej 50%, dla co najmniej z trzech niezależnych powtórzeń. I tak przykładowo, dla izopropanolu, który nie jest alergenem, wartość EC150 i EC200 (stężenie powodującą efekt powyżej progu 150% dla CD86 i 200% dla CD54) wynosi powyżej 5000 µg/ml, dla 4-Phenylenediamine, silnego alergenu, EC150<40, a EC200>1,5, a dla Imidazolidinyl urea wartości te wynoszą odpowiednio 20-90 i 20-75 (im niższe stężenie, wywołujące efekt, tym silniejszy alergen).
Jak działa strategia 2z3?
Zgodnie ze strategią 2 z 3, potencjał uczulający substancji określa się na podstawie wyników uzyskanych z trzech powyżej opisanych metod, przy czym wynik każdej z metod jest równoważny.
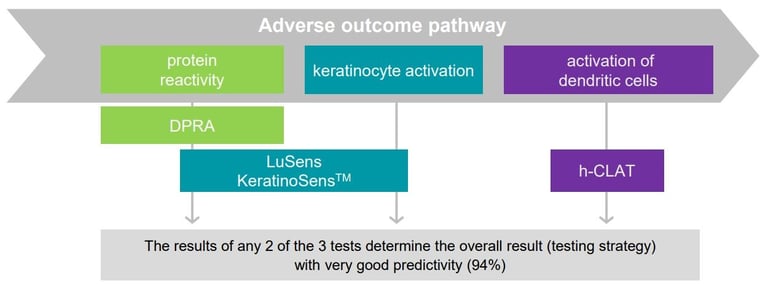
Naukowcy w BASF i Givaudan mówią, że strategia ta zapewnia lepszą przewidywalność ryzyka wystąpienia alergii skórnej u ludzi, niż tradycyjne testy na zwierzętach. Jej czułość (wykrywanie substancji uczulających) to 82% i 89% (w odniesieniu do odpowiednio testu LLNA i na ludziach), a swoistość (odróżnianie wyników pozytywnych od negatywnych) odpowiednio 85% i 88%. Jest to lepsze dopasowanie, niż wyników LLNA do testów na ludziach.
Podczas stosowania metody 2z3 może dojść do sytuacji, w której podczas interpretowania wyników, uzyskane dane są niekonkluzyjne (wchodzą w zakres pogranicza stosowalności/ograniczonej stosowalności, tzw. borderline). Jeśli po wykonaniu 2 testów otrzymujemy zgodne wyniki, możliwa jest ocena "substancja uczulająca" / "substancja nieuczulająca". W przeciwnym razie, należy wykonać trzeci test. Jeśli wyniki dwóch z trzech przeprowadzonych testów będą konkluzyjne, można dokonać klasyfikacji, jeśli nie - wymagane będą dalsze badania.
Wiele składników kosmetycznych może być jednak trudno ocenić metodą 2 z 3 (ze względu na ograniczenia testów), szczególnie substancji lipofilowych (np. oleje), składniki będące mieszaninami wielu związków chemicznych (np. ekstrakty roślinne) czy pro- i prehapteny.
W tabeli poniżej pokazano przykłady substancji, dla których przewidziano prawidłowo działanie uczulające na skórę zgodnie z metodą 2z3.
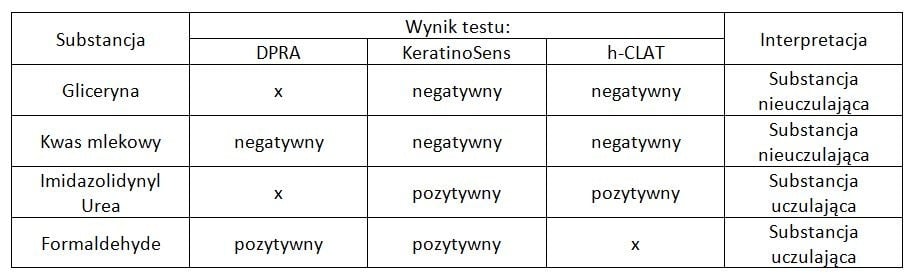
Oczywiście nie zawsze metoda ta się sprawdza i zidentyfikowano już substancje, które dają w tym podejściu wyniki fałszywie ujemne (2z3 wskazuje, że nie uczulają, podczas gdy takie działanie dla nich wcześniej udowodniono), np. kumaryna, która daje wynik ujemny w h-CLAT i DPRA oraz pozytywny w KeratinoSens oraz fałszywie dodatnie (2z3 wskazuje na działanie uczulające, którego nie ma), np. propylparaben. Z punktu widzenia bezpieczeństwa i regulacji prawnych, groźniejsze są wyniki fałszywie ujemne. Dotychczasowe analizy wykazują jednak, że w takich przypadkach mamy do czynienia ze słabymi substancjami uczulającymi, a więc ryzyko jest niskie.
Ocena siły substancji uczulającej
Jak już wcześniej wspomniano, do prawidłowej oceny działania uczulającego na skórę potrzebne jest nie tylko rozróżnienie uczula/nie uczula, ale także określenie, jak silnym alergenem jest dana substancja. Do oceny potencjału uczulającego BASF i Givaudan opracowały i zwalidowały metodę kDPRA (ang. kinetic direct peptide reactivity assay), która jest modyfikacją metody DPRA. Podczas gdy w DPRA pomiaru dokonuje się dla jednego stężenia i punktu czasowego, w kDPRA wykorzystuje się 5 różnych stężeń i sześć punktów czasowych (od 30 do 1440 min) oraz tylko peptyd zawierający cysteinę. Wyniki w odpowiedni sposób przelicza się tak, aby uzyskać parametr log kmax, czyli logarytm ze stałej reakcji. Jeśli:
- log kmax ≥ -2, substancję klasyfikuje się jako uczulającą na skórę w kategorii 1A,
- log kmax < -2, nie można dokonać samodzielnej oceny i klasyfikuje się jako 1B lub jako nieuczulającą.
W ten sposób można klasyfikować substancje, a więc w połączeniu ze strategią 2z3 będzie to pełne wypełnienie standardów dla oceny działania uczulającego na skórę. I tak przykładowo dla Methylisothiazolinone, sklasyfikowanego zgodnie z GHS jako substancja uczulająca kategorii 1A, zakres uzyskiwanych wartości kmax wynosi od -0.5 do -0.1, co daje prawidłową predykcję.
Przyszłość badań alternatywnych
Metody alternatywne dla badań na zwierzętach są koniecznym do wdrożenia punktem oceny toksykologicznej. Niestety są trudne do zaprojektowania i jeszcze trudniejsze w walidacji. Stąd proces ich wdrażania trwa wiele lat. Powstaje coraz więcej narzędzi i baz danych, ułatwiających analizę. Przykładowo Cosmetics Europe, czyli europejskie stowarzyszenie branży kosmetycznej, stworzyło i udostępniło bazę danych dla 128 substancji na temat substancji uczulających na skórę, w której zestawiono dane pochodzące z pięciu różnych metod alternatywnych (w tym DPRA, KeratinoSens i h-CLAT) z danymi pochodzącymi z badań na ludziach (metody: human maximization tests (HMT), human repeat insult patch tests (HRIPT), diagnostic patch test (DPT)) i zwierzętach (metoda LLNA). Jest to przydatne narzędzie przy ocenie bezpieczeństwa.
Z punktu widzenia całkowitego cruelty-free podczas testowania substancji, nawet metody alternatywne mają pewną "rysę na wizerunku". Metody in vitro wymagają hodowli komórkowych, a odpowiednie prowadzenie takich hodowli wymaga używania różnych substancji odżywczych i pomocniczych pochodzenia odzwierzęcego. Najczęściej są to sera (FBS, BSA), enzymy (trypsyna) i przeciwciała. Zastąpienie tych składników innymi substancjami, niepowiązanymi w żaden sposób ze zwierzętami, będzie kolejnym, poważnym krokiem do celu całkowitego cruelty-free.
Źródła:
1. World’s first toxicology testing strategy without animal testing adopted by OECD, dostęp 02.07.2021 link
2. BASF and Givaudan Develop Animal Testing Alternatives, dostęp 02.07.2021 link
3. World's first toxicology testing strategy without animal testing adopted by OECD, dostęp 02.07.2021 link
4. ‘A big step forward’: BASF and Givaudan receive OECD approval on animal-free skin sensitisation and allergen potency testing strategy, dostęp 02.07.2021 link
5. The Adverse Outcome Pathway for Skin Sensitisation Initiated by Covalent Binding to Proteins Part 1: Scientific Evidence link
6. Skin sensitisation: the Direct Peptide Reactivity Assay (DPRA), dostęp 02.07.2021 link
7. Test Guideline No. 442C Key Event-Based Test Guideline for in chemico skin sensitisation assays addressing the Adverse Outcome Pathway Key Event on Covalent Binding to Proteins, 2021 link
8. KEY EVENT BASED TEST GUIDELINE 442D IN VITRO SKIN SENSITISATION ASSAYS ADDRESSING THE AOP KEY EVENT ON KERATINOCYTE ACTIVATION, 2018 link
9. ARE-Nrf2 Luciferase Test Method (OECD TG 442D), dostęp 02.07.2021 link
10. Skin Sensitisation: the KeratinoSen assay, dostęp 02.07.2021 link
11. Skin Sensitisation: the human Cell Line Activation Test (h-CLAT), dostęp 02.07.2021 link
12. KEY EVENT-BASED TEST GUIDELINE IN VITRO SKIN SENSITISATION ASSAYS ADDRESSING THE KEY EVENT ON ACTIVATION OF DENDRITIC CELLS ON THE ADVERSE OUTCOME PATHWAY FOR SKIN SENSITISATION, 2018 link
13. Skin Sensitization and AOP, dostęp 02.07.2021 link
14. Defined Approaches for Skin Sensitization (Based on OECD TG 497), dostęp 05.07.2021 link
15. In Vitro Skin Sensitization – the 2 out of 3 Approach, BASF presentation, dostęp 05.07.2021 link
16. Leontaridou et al., The Borderline Range of Toxicological Methods: Quantification and Implications for Evaluating Precision, 2017, ALTEX - Alternatives to animal experimentation, 34, 525-538 link
17. World's first toxicology testing strategy without animal testing adopted by OECD, dostęp 08.07.2021 link
18. Marigliani et al., The Overt and Hidden Use of Animal-Derived Products in Alternative Methods for Skin Sensitisation: A Systematic Review, 2019, Alternatives to Laboratory Animals, 47 link
19. Webinar on testing and assessment methodologies. Defined approches for skin sensitisation, OECD, dostęp 08.07.2021 link
20. Hoffmann et al., Non-animal methods to predict skin sensitization (I): the Cosmetics Europe database, 2018, Critical Reviews in Toxicology, 48, 344-358 link
21. Kleinstreuer et al., Non-Animal Methods to Predict Skin Sensitization (II): an assessment of defined approaches, 2018, Critical Reviews in Toxicology, 48, 359-374 link
22. Urbisch et al., Assessing skin sensitization hazard in mice and men using non-animal test methods, 2015, Regulatory Toxicology and Pharmacology, 71, 337-351 link
23. Barthe et al., Safety Testing of Cosmetic Products: Overview of Established Methods and New Approach Methodologies (NAMs), 2021, Cosmetics, 8 link
24. Steiling, Safety Evaluation of Cosmetic Ingredients Regarding Their Skin Sensitization Potential, 2016, Cosmetics, 3 link
25. DRAFT OECD GUIDELINE FOR THE TESTING OF CHEMICALS Key–Event-Based Test Guideline For In Chemico Skin Sensitisation Assays Addressing The Adverse Outcome Pathway Key Event On Covalent Binding To Proteins, 2020 link
26. GHS Classification Criteria for Skin Sensitization, dostęp 11.07.2021 link
27. THE SCCS NOTES OF GUIDANCE FOR THE TESTING OF COSMETIC INGREDIENTS AND THEIR SAFETY EVALUATION 11TH REVISION, 2021 link
28. Guideline No. 497 Guideline on Defined Approaches for Skin Sensitisation, 2021 link
29. Implementation of Three in vitro test methods for skin sensitisation safety assessment, dostęp 12.07.2021 link
30. Kolle et al., A review of substances found positive in 1 of 3 in vitro tests for skin sensitization, 2019, Regulatory Toxicology and Pharmacology, 106, 352-368 link
