Może to jej urok, może to bimatoprost
Bimatoprost i pochodne prostaglandyn w kosmetykach


Zapewne każdy, kto szukał skutecznej odżywki do rzęs, zna Bimatoprost. Jest to o tyle ciekawy składnik, że efekt zagęszczania rzęs odkryto jako efekt uboczny leków stosowanych w jaskrze do zmniejszania ciśnienia wewnątrzgałkowego. Pierwsze raporty donoszące o takim działaniu pochodzą z roku 1997. W 2008 roku amerykańska FDA (agencja zajmująca się m.in. lekami i kosmetykami), dopuściła preparat Lattise zawierający 0,03% bimatoporostu (co ciekawe zalecono używanie 1 kropli produktu dziennie za pomocą jednorazowego aplikatora, który powinien być wyrzucany po użyciu). Człowiek posiada od ok. 90 do 160 rzęs na każdej górnej i 75-80 – dolnej powiece. Faza wzrostu dla rzęs – anagen – trwa ok. 30 dni, po niej następuje katagen (ok. 15 dni) i telogen – faza spoczynku, zakończona wypadnięciem rzęsy, trwa ok. 100 dni. Bimatoprost i latanoprost są pochodnymi prostaglandyn (grupa hormonów). Mechanizm ich działania opiera się na indukowaniu i wydłużaniu fazy anagenu, przez co zwiększa się ilość, grubość i długość rzęs. Powodują one również ciemnienie rzęs dzięki indukowaniu melanogenezy. Przykładowo w jednym z badań, u 77% pacjentów (z 317) stosujących latanoprost wystąpiła hipertrofia rzęs. Wydłużenie o 25% rzęs zidentyfikowano po 16 tygodniach stosowania raz dziennie bimatoporstu i to bimatoprost wykazuje silniejsze działania na wzrost rzęs niż latanoprost. Pozytywne efekty na wzrost rzęs otrzymuje się po stosowaniu 0,03% bimatoprostu przez okres od 1 do 3 miesięcy. Badanie kliniczne (podwójnie zaślepione, z kontrolą placebo), w którym stosowano 0,03% bimatoprostu u osób cierpiących na hipotrofię rzęs z powodu chemioterapii, wykazało wszystkie pozytywne efekty działania bimatoprostu na wzrost rzęs oraz jego dobrą tolerancję przez okres 1 roku stosowania. Efekty z tego badania pokazuje zdjęcie poniżej.
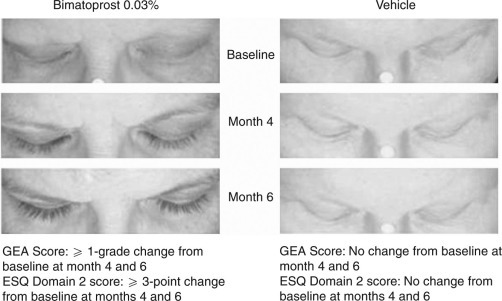

źródło ilustracji: link
Bimatoprost jest również stosowany w przypadku hipotrofii brwi. W badaniu klinicznym z 2016 (0,03% Bimatorpost, 7 miesięcy stosowania raz dziennie) udowodniono, że powoduje on wzrost ilości brwi i ich ściemnienie. Efekty przedstawia zdjęcie poniżej.
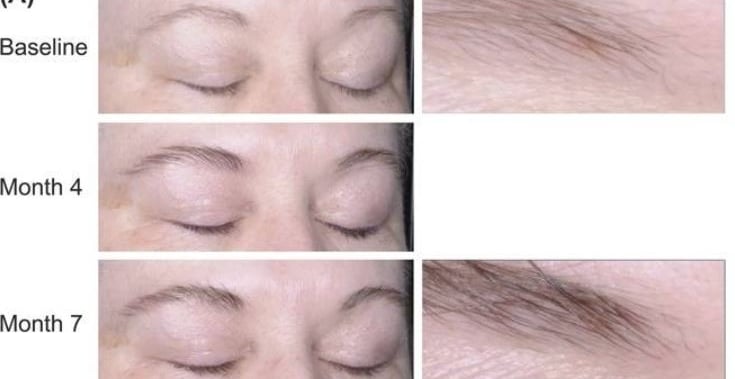
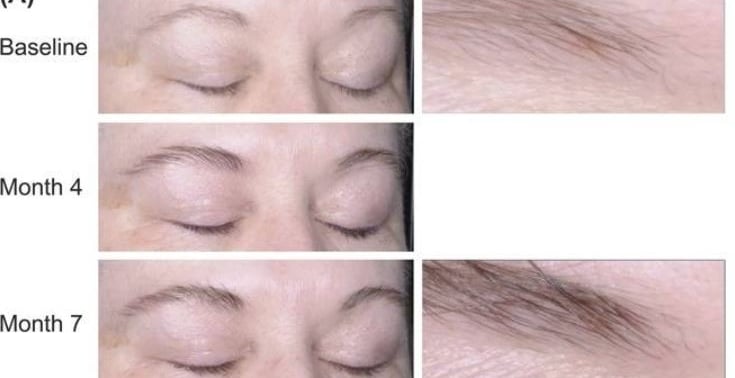
Ponieważ preparaty z pochodnymi prostaglandyn stosuje się w bezpośredniej bliskości powierzchni gałki ocznej, istnieje duże prawdopodobieństwo, że dostanie się on do oka, gdzie może wywołać efekty uboczne takie, jak przy zastosowaniu leków na jaskrę z bimatoprostem. Najczęściej (u ok. 45% pacjentów) występowało przekrwienie spojówek, pojawiało się także ciemnienie tęczówki i skóry wokół oczu, rzadziej zapalenia błony naczyniowej oka. Pacjenci z zapaleniami i infekcjami oka nie powinni stosować bimatoprostu. Najczęściej zgłaszane problemy przy zastosowaniu kosmetycznym bimatoprostu są zbieżne z tymi, pojawiającymi się przy stosowaniu jako lek na jaskrę: swędzenie oczu, przekrwienie oczu, podrażnienie oczu, zespół suchego oka, rumień i ciemnienie skóry powiek. W trakcie jednego z badań klinicznych 0,03% bimatoprostu (trwających rok, grupa badanych – osoby po chemioterapii, wpływ na wzrost rzęs) stwierdzono, że prawie 70% uczestników, którzy stosowali bimatoprost, doświadczyło co najmniej jednego efektu ubocznego. Najczęstszymi były przekrwienie spojówek, zapalenie rogówki i świąd oka. Warto zauważyć jednak, że poszerzenie naczyń spojówkowych (przekrwienie) w przypadku stosowania analogów prostaglandyn, nie jest reakcją zapalną, ale spowodowana jest uwolnieniem tlenku azotu, który powoduje rozszerzenie naczyń krwionośnych. Nie jest to więc zmiana, którą należałoby leczyć kortykosteroidami czy niesteroidowymi substancjami przeciwzapalnymi. Nie jest to również powód, dla którego powinno się przerywać stosowanie preparatu, jeśli objaw ten występuje w pierwszych dniach stosowania. Dodatkowo w wielu przypadkach zaczerwienienie nie jest obserwowane przez użytkowników, ponieważ zaleca się stosowanie odżywek z bimatoprostem na noc. Ciemnienie tęczówki spowodowane pochodnymi prostaglandyn jest nieodwracalne, a bardziej podatne są osoby z mieszanym kolorem tęczówki (z brązowymi polami). W ciągu 6-12 miesięcy stosowania objaw ten pojawił się u ok. 5-10% użytkowników latanoprostu i 1-1,5% bimatoprostu. Z kolei ciemnienie skóry okolic oczu przy stosowaniu bimatoprostu jest odwracalne i występuje u ok. 3% użytkowników. Dane z ostatnich dwóch zdań dotyczą stosowania leków na jaskrę, a nie odżywek do rzęs. Ilość danych dotycząca bezpieczeństwa bimatoprostu w aplikacji na skórę jest ograniczona. Informacje w ulotce pierwszego preparatu z bimatoprostem będącego odżywką do rzęs mówią, że najczęstszymi efektami ubocznymi stosowania tego kosmetyku są świąd oka, przekrwienie spojówek, przebarwienia skóry, podrażnienie oczu, suchość oka i pojawiają się u mniej niż 4% użytkowników. Jedna aplikacja odżywki do rzęs to ok. 5% dawki leku, który dostarcza się do oka. Stąd prawdopodobnie mniejsza częstotliwość występowania objawów ubocznych, niż w przypadku leków z bimatoprostem. Pierwsze produkty z bimatoprostem – Lattise (odżywka do rzęs) i Lumigan (lek) – zawierają chlorek benzalkoniowy jako konserwant, który stosowany do oka może działać cytotoksycznie na rogówkę i dawać objawy zespołu suchego oka. Bimatoprost jest sklasyfikowany jako substancja kategorii C w skali bezpieczeństwa w ciąży (FDA), co oznacza, że badania na zwierzętach wykazały negatywny wpływ na płód, ale nie ma odpowiednich badań na ludziach. W ulotkach leków z bimatoprostem znajduje się jednak informacja, że nie należy stosować go w trakcie ciąży i karmienia piersią.
W 2018 roku amerykańska firma kosmetyczna Rodan + Fields otrzymała pozew w związku ze swoim produktem – serum do rzęs, zawierającym Isopropyl Cloprostenate (analog prostaglandyn). W pozwie zarzucono, że firma nie ostrzega przed efektami ubocznymi stosowania substancji aktywnej z odżywki. Lattise, preparat z bimatoprostem jest obecnie jedynym dopuszczonym przez FDA preparatem do leczenia hipotrofii rzęs i podlega regulacjom, jak inne leki. Prawo dotyczące kosmetyków w USA i Unii Europejskiej różni się, m.in. nie ma tam obligatoryjnej rejestracji produktów kosmetycznych. Producenci kosmetyków wielokrotnie otrzymywali już od FDA ostrzeżenia odnośnie kosmetyków, dla których pokazywane są deklaracje a’la farmaceutyczne. W Unii Europejskiej Bimatoprost i inne analogi prostaglandyn nie są zakazane jako składniki kosmetyczne. Pod koniec października tego roku (2020) zakończył się czas składania informacji na temat prostaglandyn i ich analogów, w tym bimatoprostu, o dostarczenie których wezwała Komisja Europejska, z racji obaw, które wiążą się z tymi substancjami obecnymi w produktach kosmetycznych. W kilku krajach Europy pojawiły się doniesienia o poważnych efektach ubocznych stosowania odżywek do rzęs zawierających pochodne prostaglandyn. Na podstawie zebranych informacji ma powstać raport bezpieczeństwa sporządzony przez SCCS oraz ma być wyjaśniona kwestia rejestracji takich produktów – czy będą to mogły być kosmetyki, czy wyroby medyczne.
Pochodne prostaglandyn można znaleźć pod nazwami (według bazy CosIng):
Benzothiophenyl dephenethyllatanoprost
Triflourmethyl Dechloro Ethylprostenolamide,
Isopropyl Cloprostenate,
Ethyl Tafluprostamide,
Cyclopropylbimatoprost,
Cyclopropylmethylbimatoprost,
Dechloro cyclopropylcloprostenolamide,
Dechloro cyclopropylmethylcloprostenolamide,
Dechloro ethylcloprostenolamide,
Dehydrolatanoprost,
Dihydroxypropyl dehydrolatanoprostamide,
Dihydroxypropyl didehydrolatanoprostamide,
Ethyl tafluprostamide Ethyl travoprostamide,
Keto travoprost
Methyl travoprost
Methyl bimatoprost acidate,
Norbimatoprost,
Nortafluprost,
Tafluprost
Trifluoromethyl dehydrolatanoprost
Pod koniec września 2021 roku ukazała się wstępna opinia SCCS na temat analogów prostaglandyn stosowanych w produktach kosmetycznych. Wpłynęły jednak tylko 3 dossier dla tego typu składników - dwa dla Isopropyl Cloprostenate oraz jedno dla Ethyl Tafluprostamide (inaczej DDDE - Dechloro Dihydroxy Difluoro Ethylcloprostenolamide), które używane były w produktach gotowych (odżywkach na porost rzęs i brwi) w stężeniach odpowiednio: 0,006%, 0,007% i 0,018%. Analogi prostaglandyn dzieli się w zależności od powiązania struktury chemicznej z czterema substancjami aktywnymi stosowanymi w farmacji: tafluprost, bimatoprost, travoprost i latanoprost, co pokazuje grafika poniżej.
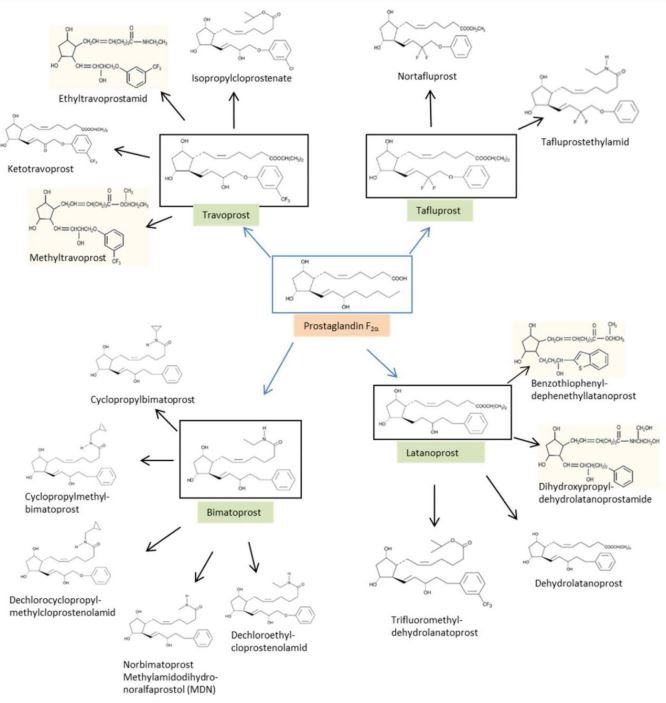

Niestety istnieje zbyt mało danych eksperymentalnych, aby SCCS mógł stwierdzić, czy analogi prostaglandyn są bezpieczne. Z tego względu dla pewnych toksykologicznych punktów końcowych (działania uczulające na skórę, kancerogenność, mutagenność i toksyczność reprodukcyjna) posłużono się w ocenie metodami in silico, czyli modelowaniem komputerowym (metody QSAR - Quantitative structure–activity relationship oraz read-across - szacowaniu przekrojowym). W wyniku zastosowania tych podejść wykazano, że:
- nie przewiduje się działania mutagennego ani genotoksycznego dla żadnego z testowanych analogów prostaglandyn,
- większość z nich została oznaczona jako potencjalne kancerogeny i/lub substancje wykazujące potencjalne toksyczne działanie na rozrodczość,
- dla kilku przewiduje się działanie uczulające na skórę.
W końcowych wnioskach SCCS podkreśla, że w swoich opiniach posługuje się oceną ryzyka składników kosmetycznych, a nie gotowych produktów (dostarczono wyniki badań gotowych produktów, które zostały przeanalizowane, ale do celów wydania opinii mają ograniczone zastosowanie). Na podstawie analizy dokumentacji dostawców oraz danych literaturowych stwierdzono, że analogi prostaglandyn mogą wywierać silne działanie farmakologiczne przy bardzo małych dawkach, a więc ich stosowanie w kosmetykach niesie ze sobą wysoki poziom obaw co do wystąpienia negatywnych skutków na zdrowie człowieka. Nie może również zostać określone bezpieczne do stosowania w produktach kosmetycznych stężenie analogów prostaglandyn.
W jednym z sierpniowych raportów systemu RAPEX widnieje serum do rzęs zawierające Bimatoprost (zgłoszenie nr A12/01168/21). Produkt zgłoszono na Węgrzech. Uzasadnienie: "Zgodnie z listą składników, produkt zawiera substancję aktywną Bimatoprost, która powinna byś stosowana pod nadzorem okulisty. Stosowanie produktu może wywołać oczne i okulistyczne skutki uboczne i nie powinien być stosowany przez kobiety w ciąży i karmiące piersią, ponieważ może to mieć wpływ na dziecko. Produkt nie jest zgodny z Rozporządzeniem w sprawie produktów kosmetycznych." Zastosowane środki zaradcze: "Zakaz wprowadzania produktu do obrotu i wszelkie środki towarzyszące. Data wejścia w życie 09.07.2021" Obecność serum w bazie RAPEX nie jest jeszcze jednoznaczne z wycofaniem produktu na terenie całej Unii Europejskiej. To od odpowiednich organów poszczególnych państw zależą podjęte środki w każdym z krajów wspólnoty.




Źródła:
1. Choi et al., Promising alternative clinical uses of prostaglandin F2α analogs: Beyond the eyelashes, 2015, Journal of the American Academy of Dermatology, 72, 712-716 link
2. Law, Bimatoprost in the treatment of eyelash hypotrichosis, 2010, Clinical Ophthalmology, 4, 349-358 link
3. Call for data on prostaglandins and their analogues used in cosmetic products, dostęp 25.11.2020 link
4. Ahluwaila, Safety and Efficacy of Bimatoprost Solution 0.03% Topical Application in Patients with Chemotherapy-Induced Eyelash Loss, 2013, Journal of Investigative Dermatology Symposium Proceedings, 16, S73-S76 link
5. Wirta et al., Safety and Efficacy of Bimatoprost for Eyelash Growth in Postchemotherapy Subjects, 2015, J Clin Aesthet Dermatol., 8, 11–20 link
6. Hollo, The side effects of the prostaglandin analogues, 2007, Expert opinion of Drug Safety, 6, 45-52 link
7. Jones, Enhanced Eyelashes: Prescription and Over-the-Counter Options, 2011, Aesthetic Plast Surg., 35, 116–121 link
8. Carruthers et al., Bimatoprost 0.03% for the Treatment of Eyebrow Hypotrichosis, 2016, Dermatol Surg., 42, 608–617 link
9. Janetos, Ocular Cosmetics: Public Safety Problem or Harmless Products?, 2019, Ophthalmic Plastic and Reconstructive Surgery, 35, 294–295 link
10. OPINION 18 on Prostaglandins and prostaglandin-analogues 19 used in cosmetic products, 2021 link
11. Rapex, zgłoszenie serum do rzęs link
12. Mus et al., SYSTEM SZYBKIEGO INFORMOWANIA O NIEBEZPIECZNYCH PRODUKTACH NIEŻYWNOŚCIOWYCH – RAPEX, 2018, Nauki inżynierskie i Technologie, 30 link
