HYDROKSYKWASY – CZY pKa JEST WAŻNE?
Podstawowa wiedza o hydroksykwasach w kontekście chemii kosmetycznej
2/1/20204 min read


Kiedy w przypadku kosmetyków mówimy o kwasach, najczęściej mamy na myśli hydroksykwasy, czyli o grupie związków o podobnej budowie, zawierające grupę karboksylową oraz hydroksylową. W zależności od wzajemnego ułożenia tych grup w cząsteczce, mówi się o α, β lub γ hydroksykwasach.
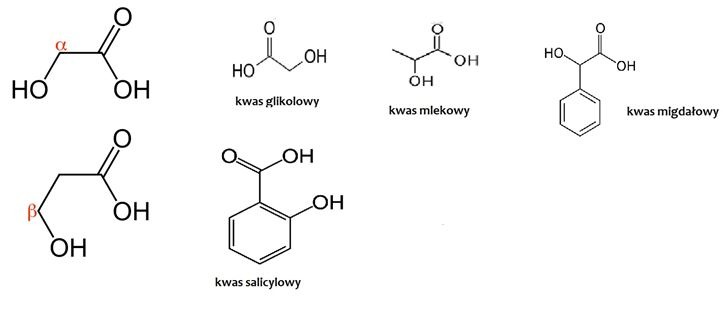
W kontekście hydroksykwasów, często mówi się o pKa i pH, jednak dla kogoś, kto z chemią nie ma na co dzień do czynienia, wydaje się trudnym do zrozumienia. Postaram się to więc przejrzyście wytłumaczyć.
Hydroksykwasy są kwasami, a więc mogą dysocjować (rozpadać się na jony) na jon hydroniowy oraz resztę kwasową. Często dla uproszczenia nie mówi się o jonie hydroniowym (H3O+) a o kationie wodoru (H+), ale w środowisku wodnym bliższy prawdy jest właśnie jon hydroniowy. Poniżej przykład dysocjacji kwasu mlekowego.
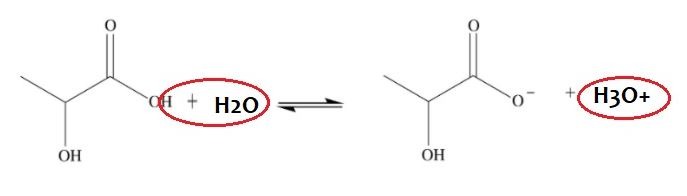
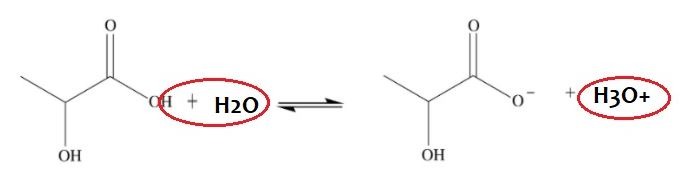
W zależności od tego, w jakim stopniu dysocjacja zachodzi, mówi się o różnej mocy kwasów. Moc kwasów wyraża się jako ujemny logarytm dziesiętny ze stałej dysocjacji kwasu, czyli jako pKa, gdzie Ka to stała dysocjacji kwasu. Im mniejsze pKa, tym mocniejszy kwas.
pKa = - log Ka
I tak np. dla kwasu mlekowego Ka = 1,4x10-4, co podstawieniu do powyższego równania daje pKa = 3,86, a dla kwasu cytrynowego Ka = 7,4x10-4 -> pKa = 3,13. Czyli kwas cytrynowy jest mocniejszy, niż mlekowy. Stała dysocjacji, niezależnie od tego, czy wyrażona jest zwykłą liczbą czy logarytmem, określa również jaka ilość kwasu jest w formie cząsteczkowej (niezdysocjowanej), a jaka w zdysocjowanej (zjonizowanej). Im mniejsze pKa, tym kwas jest „bardziej kwaśny” – chętniej dysocjuje, a w wyniku tej reakcji powstają jony hydroniowe, które „obniżają pH” (im więcej jonów hydroniowych, tym niższe pH). Kiedy pH jest równe pKa, połowa cząsteczek kwasu jest formie „wolnej”, a połowa – w zdysocjowanej (czyli np. gdy mamy 10% kwas mlekowy w pH 3,86, to 5% kwasu jest w formie wolnej, a 5% - zdysocjowanej). Kiedy pH jest mniejsze, niż pKa, dominuje forma wolna, kiedy pH jest większe niż pKa – zdysocjowana. Popatrzmy na rysunek poglądowy dla kwasu mlekowego (HA oznacza formę wolną, a A- zdysocjowaną). W pH poniżej 3,9 większość kwasu mlekowego będzie w formie wolnej, a powyżej tego pH będzie występowała w postaci zdysocjowanej.
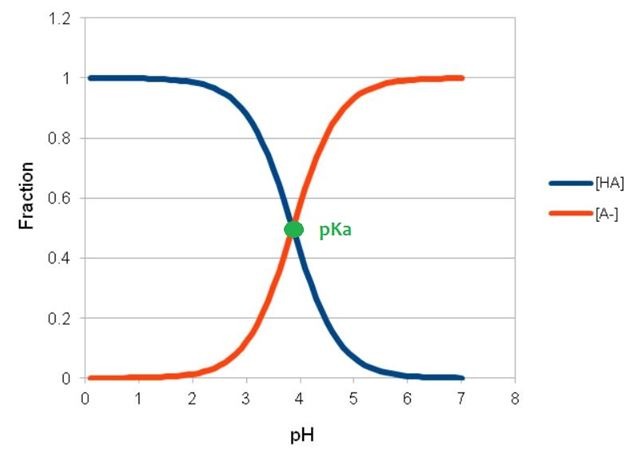
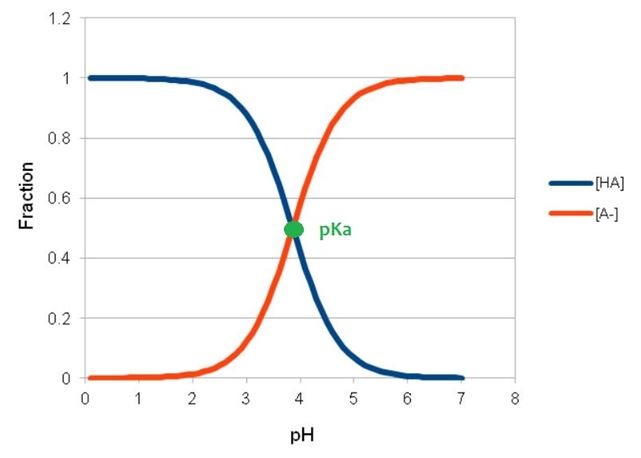
Aby pokonać warstwę rogową naskórka, α-hydroksykwasy muszą występować w formie wolnej. Im pH kosmetyku jest większe od pKa kwasu, tym więcej cząsteczek będzie występować w formie zdysocjowanej, a więc niedostępnej. I tak np. kwas mlekowy w pH 5,5 (a więc „fizjologicznym” pH), w postaci niezdysocjowanej występuje tylko w nieco ponad 2%, a więc gdy w takim preparacie stężenie kwasu wynosiło 10%, to stężenie efektywne kwasu mlekowego (stężenie formy wolnej), to trochę ponad 0,2%. Kiedy część kwasu, która jest w formie wolnej, zostaje zaabsorbowana przez skórę, pozostaje „miejsce” na kolejną partię wolnego kwasu. Aby zapewnić równowagę, zdysocjowane cząsteczki kwasu stają się nienaładowane/wolne. I znów mogą przenikać przez skórę. Jest więc możliwe, teoretycznie, że niezależnie od pH, po pewnym czasie cała ilość kwasu przejdzie do formy niezdysocjowanej i zostanie zaabsorbowana. Oczywiście na skuteczność działania hydroksykwasów wpływają nie tylko ich stężenia i pH kosmetyku, ale również matryca/baza kosmetyku, częstość stosowania, czas działania.
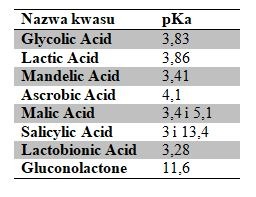
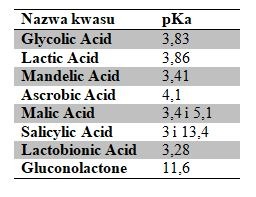
W przypadku kwasów, które zawierają więcej grup zdolnych do dysocjacji, np. kwasu jabłkowego (Malic Acid), sprawa jest jeszcze bardziej skomplikowana, ponieważ mamy dwie stałe dysocjacji pKa1 i pKa2. Na rysunku poniżej pokazano zależność pH i pKa dla kwasu jabłkowego – na żółto zaznaczono w pełni zdysocjowaną formę, na czerwono – w części zdysocjowaną, a na niebiesko – wolną (niezdysocjowaną).
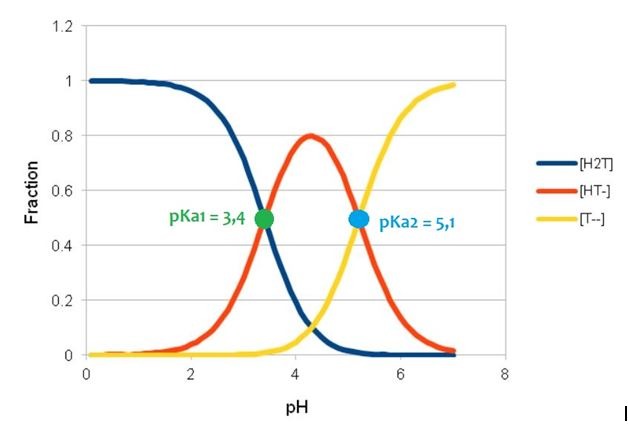
Trochę inaczej sprawa wygląd w przypadku β-hydroksykwasu – kwasu salicylowego, który ma większą cząsteczkę niż α-hydroksykwasy oraz słabo rozpuszcza się w wodzie. Działa on efektywniej w mniejszych stężeniach i wyższym pH, niż alfa-hydroksykwasy. Polihydroksykwasy (PHA) również z chemicznego punktu widzenia należą do α-hydroksykwasów. Ponieważ są jednak znacznie większymi cząsteczkami, nie penetrują skóry ani tak szybko, ani tak głęboko, jak α-hydroksykwasy. W ich przypadku pH kosmetyku nie ma już tak kluczowego znaczenia.
Im niższe pH, tym więcej cząsteczek kwasu występuje w formie wolnej i biodostępnej, ale rośnie również ryzyko podrażnień skóry (właśnie ze względu na niskie pH). Im wyższe pH, tym działanie kwasów może być słabsze, dlatego generalnie przyjmuje się, że jeśli chcemy wykorzystać złuszczające działanie α-hydroksykwasów, powinno stosować się je w stężeniach 4-10%, a pH produktu powinno być mniejsze niż 4. W przypadku kwasu salicylowego, efektywne będą stężenia 1-2%, bez większego znaczenia pH kosmetyku, natomiast dla PHA – stężenia powinny być wysokie (ok. 10%), a pH produktu również nie jest tak istotne. Alfa-hydroksykwasy w formie zjonizowanej (lub inaczej soli), działają nawilżająco. Jeśli więc mamy kosmetyk, który zawiera poniżej 5% AHA w pH powyżej 4,5, będzie on działał nawilżająco.
