B‑Biome™ Score - jak ocenić wpływ kosmetyków na mikrobiom skóry
O certyfikacji składników przyjaznych dla mikrobiomu stworzonej przez Givaudan.


Odniesienia do mikrobiomu skóry są bardzo ważnym elementem komunikacji dla wielu producentów surowców i kosmetyków. O tym, jak skomplikowane i wielowątkowe jest to zagadnienie, opisałam w artykule w numerze 1/2023 Świata Przemysłu Kosmetycznego.
Givaudan, światowy gigant - producent surowców i zapachów, opracował nową metodę oceny składników na mikrobiom skóry. Jak pisze, jest to "pierwszy naukowo udowodniony, w 100% transparentny" system do oceny, czy dany składnik jest "microbiome friendly".
W tym miejscu warto przypomnieć o istnieniu certyfikatu MyMicrobiome, opierającego się na badaniach in vitro oraz polskiemu Safe Microbiome, stworzonego przez Centrum Badań i Innowacji dr Nowaczyk, który oprócz badań in vitro przewiduje przeprowadzenie badań in vivo.
Zasady oceny
Ocena wpływu składnika na mikrobiom, zgodnie z B-Biome, opiera się na trzech kryteriach:
- krótkotrwały wpływ po jednorazowej aplikacji na skórę,
- skumulowany wpływ po kilku dniach aplikacji na skórę,
- wpływ na mikrobiom po zakończeniu używania składnika.
Badania przeprowadza się poprzez pobieranie próbek ze ściśle określonej powierzchni skóry probantów, a następnie w odpowiedni sposób przenoszone na płytki z podłożem mikrobiologicznym. Po odpowiednim czasie wzrostu, zlicza się liczbę kolonii, które wyrosły na płytkach (określa CFU). Wynikiem końcowym jest "gęstość bakteryjna", czyli stosunek CFU do powierzchni, z której pobrano próbkę (50 cm2). Wyniki porównuje się z gęstością wejściową, czyli wynikiem z próbki, którą pobrano przed nałożeniem składnika.
Do wyliczeń punktacji korzysta się z trzech wyników (odniesionych do próbki pobranej w czasie t0) gęstości bakteryjnej:
- po 5 godzinach (wpływ krótkotrwały po jednej aplikacji),
- po 3 dniach (wpływ po kilku dniach wielokrotnej aplikacji),
- po 7 dniach, ale po 5 od zakończenia aplikacji, czyli po czasie, kiedy teoretycznie gęstość może wrócić do stanu pierwotnego.
Ponieważ gęstość bakteryjna nie ma rozkładu normalnego (ważna cecha przy obliczeniach statystycznych), zamiast średniej, za parametr kluczowy przyjęto medianę (środkową wartość danych, które zostały uporządkowane od najmniejszej do największej wartości). Następnie przyznaje się punkty, zgodnie z przynależnością wyniku do danego przedziału; punkty z trzech kryteriów są sumowane, i na tej podstawie przyznawana jest ocena końcowa, wyrażana literą od A do E.
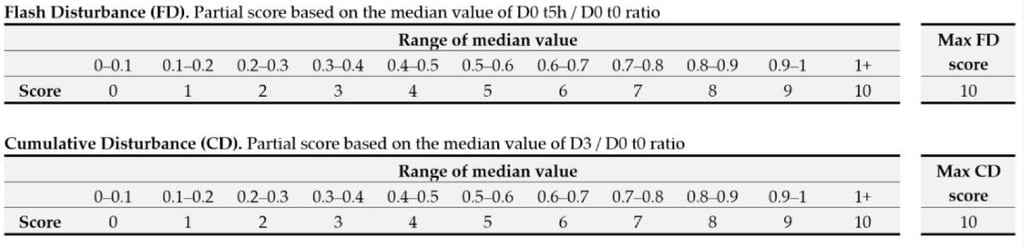
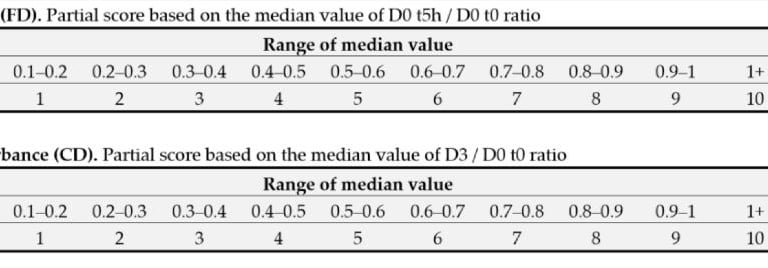


W badaniach próbki pobiera się z szyi, a nie z policzków, jak często dzieje się w badaniach podobnego typu. Badacze z Givaudan argumentują, że:
- gęstość i różnorodność bakterii na skórze policzków i szyi jest do siebie podobna,
- skóra na szyi jest mniej wystawiona na czynniki mogące zaburzać pomiary, np. dotykanie, dodatkowe kosmetyki, promieniowanie UV,
- łatwiejsze jest pobieranie wymazu u mężczyzn (obecność brody) i mniejsze ryzyko zanieczyszczenia oczu.
Przykład
W publikacji, w której opisano szczegóły metodologii, zbadano wpływ 0,9% soli fizjologicznej (czyli chlorku sodu) oraz 0,5% chlorheksydyny (substancja bakteriobójcza). Substancję nakładano na sterylny gazik, który przykładano do skóry na 15-20 sekund. Próbki pobierano w odpowiednich odstępach czasowych, w przypadku aplikacji wielokrotnej - było to nakładanie dwa razy dziennie przez 3 dni.
Poniżej wyniki gęstości bakteryjnej dla obu składników po 5 godzinach, 3 dniach i 7 dniach.
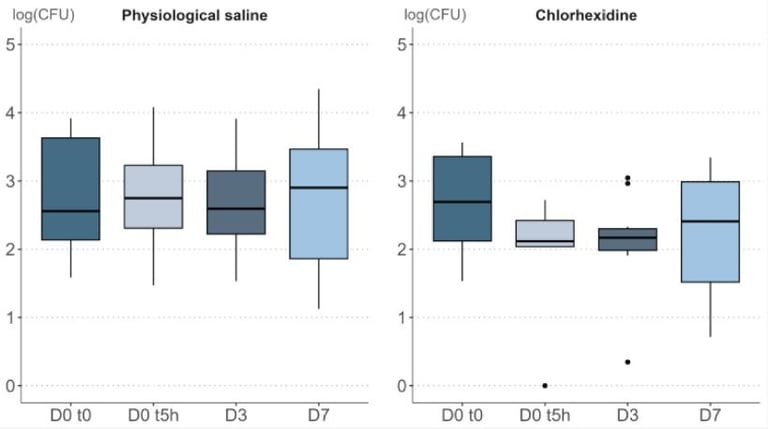
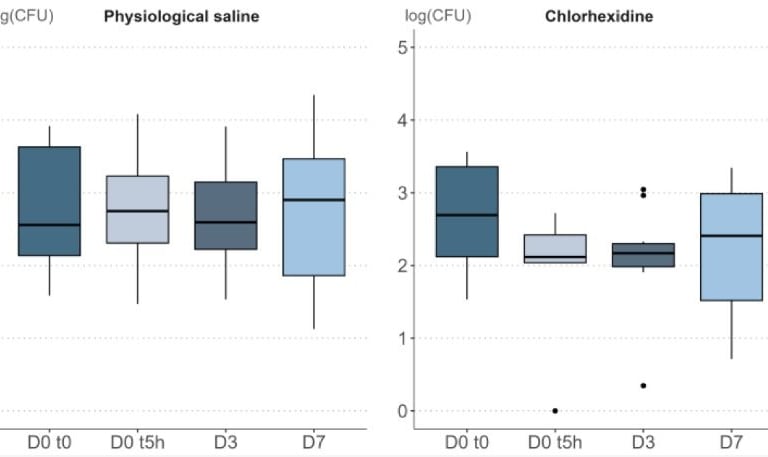
Zgodnie z przyjętymi zasadami punktacji, końcowo roztwór soli fizjologicznej otrzymał notę A, a chlorheksydyny - E.
Odniesienie do innych metod
Odniesiono się także do przeprowadzaniu podobnych badań in vitro oraz sekwencjonowania. Testy in vitro, w których składnik inkubuje się z wybranymi szczepami bakterii, charakterystycznymi dla danej partii ciała, mogą dostarczyć cennych informacji na temat interakcji między składnikiem a określonymi bakteriami docelowymi. Ograniczeniami tej metody jest to, że w takich warunkach jest wysoka dostępność do składników odżywczych, tempo wzrostu jest wysokie, zagęszczenie bakterii duże, ale złożoność kultur jest niska. Warunki in vitro nie odzwierciedlają stanu, jaki ma miejsce w realnych warunkach, na powierzchni skóry i to jest największe ograniczenie - brak wystarczającej ekstrapolacji wyników z badań in vito na deklaracje.
Sekwencjonowanie, opierające się na analizie podjednostki 16S rRNA, może być źródłem cennych informacji o składzie i różnorodności mikrobiomu. Jednak takie badania wymagają udziału wielu ochotników, aby zminimalizować różnice międzyosobniczne, składnik powinien być nakładany przez długi okres czasu - są to więc badania czasochłonne i kosztowne. W sekwencjonowaniu nie ma jednak rozróżnienia pomiędzy żywymi, martwymi czy nieaktywnymi bakteriami i nie wydaje się odpowiednia do badań wpływu krótkoterminowego.
Która metodyka badań jest więc najlepsza?
Najwięcej zależy od tego, jaką deklarację chcemy potwierdzić i jakim budżetem dysponujemy. Zagadnienia związane z wpływem kosmetyków i składników na mikrobiom są tak skomplikowane, że nie ma tutaj jednoznacznej, zawsze dobrej odpowiedzi. Każda metoda ma swoje plusy i minusy. Moim zdaniem ważne jest, aby osoby, które będą korzystać z wyników, umiały je poprawnie przedstawić i wykorzystać do tworzenia prawdziwych deklaracji.
Źródła:
Rehabilitation of Skin Bacterial Counts to Assess the Short-Term Impact of Ingredients in Topical Applications—Presenting a Culture-Based Viability Score, DOI: 10.3390/cosmetics10020050
Sprawdź ten wpis również na


